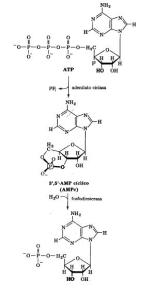
La mejor forma de empezar esta revisión es definiendo qué es el AMP cíclico. El AMP cíclico es un nucleótido que se genera a partir de ATP a través de la enzima adenilato ciclasa en respuesta a la estimulación hormonal de receptores de la superficie celular. El AMP cíclico actúa como molécula señal activando la quinasa A; se hidroliza a AMP mediante la fosfodiesterasa.
El AMP cíclico es absolutamente indispensable para la actividad de la proteína quinasa dependiente del AMP cíclico, una enzima que fosforila restos específicos de serina y/o treonina de numerosas proteínas celulares, incluyendo la fosforilasa quinasa y la glucógeno sintasa. La concentración intracelular de AMP cíclico determina la fracción de proteína quinasa que estará en su forma activa, así como también la velocidad a la cual fosforila a sus sustratos.
La concentración de AMP cíclico controla la fracción de una enzima en su forma fosforilada, también disminuyendo la velocidad a la cual este es desfosforilado. Por ejemplo en la glucógeno fosforilasa, un incremento en el AMP cíclico resulta en un aumento de la velocidad de activación de la enzima y también en una disminución de su velocidad de desactivación.
Diversos estudios en fisiología han demostrado que el AMP cíclico tiene un papel mediador del efecto de diversas hormonas. En el estudio realizado por Bürk, 1968, mostró que la cafeína y teofilina, que impiden la degradación del AMP cíclico, son capaces de afectar el crecimiento de cultivos celulares de hásmter (BHK).
Se ha podido establecer que la capacidad de proliferación de multitud de sistemas celulares es afectada, ya sea por agentes que impiden la degradación del AMP cíclico, entre ellos la cafeína y la teofilina (que afectan la actividad de las AMP ciclicofosfodiesterasas), o por mediación de agentes como las prostaglandinas, que incrementan la actividad de la adenilciclasa, enzima a la que se debe la síntesis del AMP cíclico.
En los estudios de Hsie & Puck, 1971 y Johnson, Friedman & Pastan, 1971, se observaron que las células malignas de ratón y de hámster son capaces de experimentar de manera reversible alteraciones morfológicas que demuestran un cierto retorno hacia las propiedades celulares normales, así como una disminución en la velocidad de proliferación.
Poco después, diversos laboratorios hallaron que las células normales experimentan fluctuaciones en sus niveles intracelulares de AMP cíclico. Los experimentos más representativos son los de Burger, Bombik, Breckenridge y Sheppard (1972), quienes estudiaron una población de fibroblastos normales de ratón BalbC/3T3 y observaron que, en comparación con sistemas de activa proliferación, las células en G0 tienen un mayor contenido intracelular de AMP cíclico.
Burger y colaboradores, pudieron demostrar que el estímulo a la proliferación era inefectivo cuando éste se suministraba en la fase G0 a fibroblastos Balb C/3T3 conjuntamente con niveles macromolares de AMP cíclico. Todas estas observaciones permiten concluir que el AMP cíclico está directamente involucrado en la proliferación celular regular en el sistema descrito.
Coincidente con su característica de impedir la proliferación celular, se ha observado que el AMP cíclico y sus análogos son capaces de alterar la capacidad celular de incorporar nutrientes, capacidad que es antagonizada por altas concentraciones de suero.
Esto hace pensar que el crecimiento de las células de mamíferos está controlados por mitógenos usualmente presentes en el suero como nutrientes, los cuales son capaces de contrarrestar un posible comportamiento antimitógeno del AMP cíclico. En estos estudios se observa diversos efectos del AMP cíclico, tales como su capacidad de modificar la morfología de las células malignas, son antagonizadas por la colchicina y la vinblastina, capaces de modificar la forma y adherencia celular, afectando así la organización de los microtúbulos intracelulares.
Los niveles intracelulares del AMP cíclico son regulables a base de factores como:
- su síntesis, causada por la adenilciclasa, enzima localizada en la membrana plasmática de la célula;
- su degradación, causada por los AMP cíclicos fosfodiesterasas
- su interacción con proteínas receptoras, las cuales suelen existir en asociación con proteínas quinasas, enzimas que participan en la fosforilación de proteínas cuando se liberan de su interacción con los receptores del AMP cíclico.
Esta última propiedad hace que una de las maneras como el AMP cíclico expresa su capacidad de regulación sea influenciando selectivamente la fosforilación de proteínas. Sin embargo tal acción del AMP cíclico en la fosforilación de proteínas no se limita a alteraciones en las proteínas de la membrana, sino que parece ser bastante más general. Como por ejemplo, Rieber y Bacalao (1974) han observado que ciertas condiciones impiden la entrada de células de hámster a la fase de síntesis del ADN, tales como la adición de AMP cíclico o la exposición a temperaturas de 40° C que impiden la proliferación, coinciden en producir una alteración selectiva en la fosforilación de las proteínas nucleares.
Es probable que una de las maneras en que el AMP cíclico influencia la modulación celular sea por medio de su vinculación diferencial con proteínas receptoras, lo cual puede determinar alteraciones importantes en la fosforilación de las proteínas, tanto nucleares, como citoplasmáticas y de las membranas.
En un estudio sobre la proteína CREB (Cyclic AMP-Responsive Element Binding) (Abramovitch et al, 2004), se menciona su importancia como factor de transcripción por múltiples vías de señales de transducción en respuesta a un estímulo externo como: la actividad sináptica, los factores de crecimiento hormonal, las citoquinas y el estrés. Existen dos regiones independientes, conservadas; que su activación es a través del CREB: a)el dominio inducible de la quinasa, el cual contiene un residuo de serina en un sitio consenso de forsforilación 133 (1,2) y b) un dominio básico zipper-leucina que regula la eficiencia de la unión del CREB a su elemento promotor afín CRE (una secuencia palindrómica consenso TGACGTCA).
A pesar que varias vías de señalización convergen a CREB, un estímulo externo específico puede activar un repertorio designado de genes. Previamente demostraron que bajo condiciones reducidas, CREB se une más eficientemente a su sitio de unión de ADN e incrementa la expresión génica en condiciones de hipoxia relativamente a normoxia. Este efecto es probablemente independiente a la fosforilación del CREB porque ellos no detectaron un cambio significativo en la relación entre un estado fosforilado y no fosforilado. las proteínas CREB tienen un mecanismo intrínseco de medir las concentraciones de oxígeno en la célula, permitiendo que hayan cambios en el nivel de expresión de los genes regulados por CREB.
En respuesta a la hipoxia, se dan procesos biológicos significativos, incluyendo la proliferación celular, la angiogénesis, procesos metabólicos, apoptosis e inmortalización celular implicando modificaciones malignas. Esta bien documentado que en diferentes líneas celulares, CREB media la expresión de una variedad de genes de respuesta a la hipoxia, incluyendo el factor de crecimiento vascular endotelial, lactato dehidrogenasa (LDH1) y los genes antiapoptóticos como IAP2 y Bcl2.
Varios estudios han revelado el rol de la familia de activadores CREB en el control de la supervivencia y proliferación celular. Alteraciones en la unión de CRE con pérdida de la expresión de CREB fueron observadas en el cáncer adenocortical de la línea celular H295R. Alteraciones similares fueron encontradas en el tumor maligno adenocortical. Además se demostró que las CREB esta involucrado en el control de las metástasis en casos de células con melanoma. Por lo tanto parece que las diversas alteraciones que conducen a la activación o inactivación de componentes claves de las vías de señalización de AMPc se observan en la tumorigenesis.
Glorario:
1. CREB: es una proteína que actúa como factor de transcripción. Se une a ciertas secuencias de ADN llamadas «elementos de respuesta a AMPc», mediante los cuales incrementa o reduce la transcripción «downstream» regulada por estos genes.
Fuentes:
Abramovitch R, Tavor E, Jacob-Hirsch J, Zeira E, Amariglio N, Pappo O, Rechavi G, Galun E, Honigman A (2004) A Pivotal Role of Cyclic AMP- Responsive Element Bindig Protein in Tumor Progression, Cancer Research, 64, 1338-1346.
Rieber M (1977) Aspectos de Biología Celular y Transformación Maligna, Programa Regional de Desarrollo Científico y Tecnológico, Secretaría General de la OEA.
Voet D, Voet G. J (2004) Bioquímica, 3ra Edición, Buenos Aires: Médica Panamericana, 2006.